धातु और अधातु
धातु
धातु वे तत्व हैं जो ऊष्मा और विद्युत् का संचालन करते हैं और लचीले और तार खींचने योग्य होते हैं।
उदाहरण:- आयरन (Fe), एल्युमिनियम (Al), सिल्वर (Ag), कॉपर (Cu), गोल्ड (Au), प्लेटिनम (Pt), सोडियम (Na), पोटैशियम (K), कैल्शियम (Ca), लेड ( Pb), मैग्नीशियम (Mg), लिथियम (Li) आदि।
धातु वे तत्व हैं जो इलेक्ट्रॉनों का त्यागकर धनात्मक आयन बनाते हैं। इस प्रकार धातुओं को विद्युत धनात्मक तत्व के रूप में जाना जाता है।
धातुओं के भौतिक गुण
1. धातुएँ कठोर और चमकदार होती हैं।
अधिकांश धातुएँ कठोर होती हैं, क्षार धातुओं को छोड़कर, जैसे सोडियम, पोटेशियम, लिथियम आदि बहुत नरम धातुएँ होती हैं। इन्हें चाकू से काटा जा सकता है।
2. धातुएँ प्रबल और तन्य होती हैं।
अधिकांश धातुएं मजबूत होती हैं और इनमें उच्च तन्यता शक्ति होती है। इस वजह से, तांबे (Cu) और आयरन (Fe) जैसी धातुओं का उपयोग करके बड़ी संरचनाएं बनाई जाती हैं। सोडियम (Na) और पोटेशियम (K) को छोड़कर जो नर्म धातु हैं।
3. धातुएँ ठोस होती हैं।
पारा (Hg) को छोड़कर धातु कमरे के तापमान पर ठोस होती है, जो कमरे के तापमान पर तरल होती है।
4. धातुएँ ऊष्मा और विद्युत का संचालन करती हैं।
धातुएँ ऊष्मा और विद्युत की सुचालक होती हैं। यही कारण है कि बिजली के तार तांबे और एल्युमिनियम जैसी धातुओं से बने होते हैं। सीसा और पारा ऊष्मा के कुचालक हैं।
5. धातुएँ ध्वनिक होती हैं।
धातुएँ ध्वनिक होती हैं क्योंकि वे बजने वाली ध्वनि उत्पन्न करती हैं। धातुओं की ध्वनि को धात्विक ध्वनि भी कहते हैं। यही कारण है कि यंत्र बनाने में धातु के तारों का प्रयोग होता है।
6. धातुएं आघातवर्धनीय होती हैं।
इसका मतलब है कि धातुओं को पीटकर एक पतली शीट बनाई जा सकती है। इसी गुण के कारण लोहे का उपयोग बड़े-बड़े जहाज बनाने में किया जाता है।
7. धातुएँ तन्य होती हैं।
इसका मतलब है कि धातुओं को पतले तार में खींचा जा सकता है। इसी गुण के कारण एक तार धातुओं का बना होता है।
8. धातुओं का गलनांक और क्वथनांक उच्च होता है।
सोडियम (Na) और पोटेशियम (K) को छोड़कर धातुओं में आमतौर पर उच्च गलनांक और क्वथनांक होता है।
9. धातुओं का घनत्व अधिक होता है।
10. अधिकांश धातुएं धूसर रंग की होती हैं। लेकिन सोना और तांबा अपवाद हैं।
धातुओं के रासायनिक गुण
1. ऑक्सीजन के साथ अभिक्रिया
अधिकांश धातुएं ऑक्सीजन के साथ अभिक्रिया करते समय संबंधित धातु ऑक्साइड बनाती हैं।
धातु + ऑक्सीजन → धातु ऑक्साइड
उदाहरण:-
1. पोटेशियम और सोडियम धातु ऑक्सीजन के साथ अभिक्रिया करने पर पोटेशियम ऑक्साइड बनाते हैं।
4K + O2 → 2K2O
4Na + O2 → 2Na2O
सोडियम (Na), पोटैशियम (K), लिथियम (Li) आदि क्षार-धातु कहलाते हैं। क्षार धातुएँ ऑक्सीजन के साथ तीव्रता से अभिक्रिया करती हैं।
सोडियम धातु को मिट्टी के तेल में क्यों डुबो कर रखा जाता है?
सोडियम और पोटैशियम इतनी तीव्र अभिक्रिया करते हैं कि खुले में रखने पर उनमें आग लग जाती है। इसलिए इनकी सुरक्षा और आकस्मिक आग से बचने के लिए इन्हें मिट्टी के तेल में डुबो कर रखा जाता है।
कुछ धातु ऑक्साइड सुरक्षात्मक परत बनाते हैं।
1. सामान्य तापमान पर, मैग्नीशियम (Mg), एल्युमिनियम (Al), जिंक (Zn), लेड (Pb) आदि धातुओं की सतहों को ऑक्साइड की एक पतली परत से ढक दिया जाता है। सुरक्षात्मक ऑक्साइड परत धातु को आगे ऑक्सीकरण से रोकती है।
2Mg + O2 → 2MgO
4Al + 3O2 → 2Al2O3
2Zn + O2 → 2ZnO
2Pb + O2 → 2PbO
2. कॉपर कमरे के तापमान पर ऑक्सीजन के साथ अभिक्रिया नहीं करता है लेकिन हवा में जलाने पर यह ऑक्साइड देता है।
2Cu + O2 → 2CuO
3. लोहा (Fe) गर्म करने पर नहीं जलता है लेकिन बर्नर की लौ में छिड़कने पर लोहे का बुरादा तेजी से जलता है।
4Fe + 3O2 → 2Fe2O3
4. सिल्वर (Ag), गोल्ड (Au) और प्लेटिनम (Pt) उच्च तापमान पर भी हवा की ऑक्सीजन के साथ नहीं जुड़ते हैं। वे कम से कम प्रतिक्रियाशील हैं।
2. धातुओं की जल के साथ अभिक्रिया
ठंडे पानी के साथ धातु की अभिक्रिया
धातुएँ जल से अभिक्रिया करके धातु हाइड्रॉक्साइड तथा हाइड्रोजन गैस बनाती हैं।
धातु + जल → धातु हाइड्रॉक्साइड + हाइड्रोजन
उदाहरण:-
1. सोडियम तथा पोटैशियम धातुएँ ठंडे जल से तीव्र अभिक्रिया करके सोडियम तथा पोटैशियम हाइड्रॉक्साइड तथा हाइड्रोजन गैस बनाती हैं। अभिक्रिया ऊष्माक्षेपी होती है इसलिए उत्पन्न हाइड्रोजन गैस में आग लग जाती है।
2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g) + ऊष्मा ऊर्जा
2Na(s) + 2H2O (l) → 2NaOH (aq) + H2 (g) + ऊष्मा ऊर्जा
2. कैल्सियम जल से अभिक्रिया करने पर कैल्सियम हाइड्रॉक्साइड तथा हाइड्रोजन गैस बनाता है। पानी के साथ कैल्शियम की अभिक्रिया कम हिंसक होती है। हाइड्रोजन में आग पकड़ने के लिए पर्याप्त ऊष्मा विकसित नहीं होती है।
Ca (s) + 2H2O (l) → Ca(OH)2 (aq) + H2 (g)
कैल्शियम तैरने लगता है क्योंकि हाइड्रोजन गैस के बुलबुले धातु की सतह से चिपक जाते हैं।
गर्म पानी के साथ धातु की अभिक्रिया
3. मैग्नीशियम ठंडे जल से अभिक्रिया नहीं करता है। यह गर्म पानी के साथ अभिक्रिया करके मैग्नीशियम हाइड्रॉक्साइड और हाइड्रोजन बनाता है। हाइड्रोजन गैस के बुलबुले इसकी सतह से चिपके रहने के कारण भी तैरने लगते हैं।
Mg (s) + H2O (l) → Mg(OH)2 (aq) + H2 (g)
भाप के साथ धातु की प्रतिक्रिया
4. जब भाप मैग्नीशियम धातु के ऊपर पड़ती है, तो मैग्नीशियम ऑक्साइड और हाइड्रोजन गैस बनती है।
Mg (s) + H2O (g) → MgO (s) + H2 (g)
5. एल्युमिनियम, आयरन और जिंक जैसी धातुएं ठंडे या गर्म पानी से अभिक्रिया नहीं करती हैं। लेकिन वे भाप के साथ क्रिया करके धातु ऑक्साइड और हाइड्रोजन बनाते हैं।
2Al (s) + 3H2O (g) → Al2O3 (s) + 3H2 (g)
3Fe (s) + 4H2O (g) → Fe3O4 (s) + 4H2 (g)
Zn (s) + H2O (g) → ZnO (s) + H2 (g)
(**धातुएं जैसे सीसा, तांबा, चांदी और सोना पानी के साथ बिल्कुल भी अभिक्रिया नहीं करते हैं।)
जल के प्रति विभिन्न धातुओं की अभिक्रियाशीलता का क्रम इस प्रकार लिखा जा सकता है-
K > Na > Ca > Mg > Al > Zn > Fe > Pb > Cu > Ag > Au
3. तनु अम्ल के साथ धातु की अभिक्रिया
तनु अम्ल के साथ अभिक्रिया करने पर धातुएँ संबंधित धातु लवण बनाती हैं।
धातु + तनु अम्ल → धातु लवण + हाइड्रोजन
उदाहरण:-
हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया
1. तनु हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करने पर सोडियम और मैग्नीशियम धातु सोडियम और मैग्नीशियम क्लोराइड और हाइड्रोजन गैस देती है।
2Na (s) + 2HCl (aq) → 2NaCl (aq) + H2 (g)
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
सल्फ्यूरिक एसिड के साथ अभिक्रिया
2. जिंक सल्फेट और हाइड्रोजन गैस तब बनती है जब जिंक तनु सल्फ्यूरिक एसिड के साथ अभिक्रिया करता है। इस विधि का प्रयोग प्रयोगशाला में हाइड्रोजन गैस बनाने के लिए किया जाता है।
Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g)
जब धातु को नाइट्रिक एसिड (HNO3) के साथ उपचयित किया जाता है तो हाइड्रोजन गैस उत्पन्न नहीं होती है
3. नाइट्रिक एसिड प्रबल ऑक्सीकरण एजेंट है और यह हाइड्रोजन गैस (H2) को पानी (H2O) में ऑक्सीकृत करता है और स्वयं नाइट्रोजन के कुछ ऑक्साइड जैसे नाइट्रस ऑक्साइड (N2O), नाइट्रिक ऑक्साइड (NO) और नाइट्रोजन डाइऑक्साइड (NO2) में अपचयित हो जाता है। .
Zn (s) + 4HNO3 (aq) → Zn(NO3)2 (aq) + 2NO2 (g) + 2H2O (l)
3Cu (s) + 8HNO3 (aq) → 3 Cu(NO3)2 (aq) + 2NO (g) + 4H2O (l)
अपवाद:- मैग्नीशियम और मैगनीज अत्यधिक तनु नाइट्रिक अम्ल के साथ क्रिया करके हाइड्रोजन गैस मुक्त करते हैं।
Mg (s) + 2HNO3 (aq) → Mg(NO3)2 (aq) + H2 (g)
Mn (s) + 2HNO3 (aq) → Mn(NO3)2 (aq) + H2 (g)
(**तांबा, सोना और चांदी महान धातु के रूप में जाने जाते हैं। ये पानी या तनु अम्ल के साथ प्रतिक्रिया नहीं करते हैं।)
तनु हाइड्रोक्लोरिक एसिड या सल्फ्यूरिक एसिड के प्रति धातु की प्रतिक्रियाशीलता का क्रम इस प्रकार है-
K > Na > Ca > Mg > Al > Zn > Fe > Cu > Hg > Ag
4. अन्य धातु लवण के विलयन के साथ धातु की अभिक्रिया
अन्य धातु लवणों के विलयन के साथ धातुओं की अभिक्रिया विस्थापन अभिक्रिया है। इस अभिक्रिया में अधिक क्रियाशील धातु कम क्रियाशील धातु को अपने लवण से विस्थापित कर देती है।
धातु A + धातु B का नमक → धातु A का नमक + धातु B
उदाहरण:-
1. आयरन कॉपर सल्फेट के विलयन से कॉपर को विस्थापित कर देता है।
Fe + CuSO4 → FeSO4 + Cu
2. एल्युमिनियम कॉपर सल्फेट के विलयन को विस्थापित कर देता है।
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
3. जिंक कॉपर सल्फेट के विलयन को विस्थापित करता है।
Zn + CuSO4 → ZnSO4 + Cu
4. जब कॉपर को सिल्वर नाइट्रेट के विलयन में डुबोया जाता है, तो यह सिल्वर को विस्थापित कर कॉपर नाइट्रेट बनाता है।
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
अभिक्रिया में, तांबा चांदी की तुलना में अधिक अभिक्रियाशील होता है और इसलिए, चांदी के रूप में चांदी के नाइट्रेट समाधान को विस्थापित करता है।
5. सिल्वर मेटल कॉपर सल्फेट के घोल से अभिक्रिया नहीं करता है क्योंकि सिल्वर कॉपर की तुलना में कम सक्रीय होता है और कॉपर को अपने लवणीय विलयन से विस्थापित करने में सक्षम नहीं होता है।
Ag + CuSO4 → कोई अभिक्रिया नहीं
इसी प्रकार, जब सोना कॉपर नाइट्रेट के घोल में डुबोया जाता है, तो कोई अभिक्रिया नहीं होती है क्योंकि तांबा सोने की तुलना में अधिक अभिक्रियाशील होता है।
Au + CuSO4 → कोई अभिक्रिया नहीं
और, एल्युमिनियम नाइट्रेट के विलयन में कॉपर को डुबाने पर कोई अभिक्रिया नहीं होती है क्योंकि कॉपर एल्युमिनियम की तुलना में कम क्रियाशील होता है।
Cu + Al(NO3)3 → कोई प्रतिक्रिया नहीं
धातु आक्साइड
रासायनिक गुण
धातु के ऑक्साइड क्षारीय प्रकृति के होते हैं। धातु ऑक्साइड का जलीय विलयन लाल लिटमस को नीला कर देता है।
1. धातु ऑक्साइड की जल के साथ अभिक्रिया
अधिकांश मेटा ऑक्साइड पानी में अघुलनशील होते हैं। क्षार धातु के आक्साइड पानी में घुलनशील होते हैं। क्षार धातु के आक्साइड पानी में घुलने पर प्रबल क्षार देते हैं।
उदाहरण:-
1. सोडियम ऑक्साइड जल से अभिक्रिया करने पर सोडियम हाइड्रॉक्साइड देता है।
Na2O + H2O → 2NaOH
2. पोटैशियम ऑक्साइड जल से अभिक्रिया करने पर पोटैशियम हाइड्रॉक्साइड देता है।
K2O + H2O → 2KOH
2. उभयधर्मी ऑक्साइड
कुछ धातु ऑक्साइड जैसे एल्युमिनियम ऑक्साइड, जिंक ऑक्साइड आदि अम्लीय और क्षारीय दोनों प्रकार के व्यवहार प्रदर्शित करते हैं। ऐसे धातु ऑक्साइड जो अम्ल और क्षार दोनों के साथ क्रिया करके लवण और जल बनाते हैं, उभयधर्मी ऑक्साइड कहलाते हैं। यह अम्ल की तरह क्षार के साथ अभिक्रिया करता है और क्षार की तरह अम्ल के साथ अभिक्रिया करता है।
उदाहरण:- धातु के ऑक्साइडों की अम्लों के साथ अभिक्रिया
1. ऐलुमिनियम ऑक्साइड हाइड्रोक्लोरिक अम्ल से अभिक्रिया करके ऐलुमिनियम क्लोराइड लवण तथा जल बनाता है।
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. जिंक ऑक्साइड हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करने पर जिंक क्लोराइड और पानी देता है।
ZnO + 2HCl → ZnCl2 + H2O
क्षार के साथ धातु आक्साइड की अभिक्रिया
3. ऐलुमिनियम ऑक्साइड सोडियम हाइड्रॉक्साइड से अभिक्रिया करके सोडियम ऐलुमिनेट तथा जल उत्पन्न करता है।
Al2O3 + 2NaOH → 2NaAlO2 + H2O
4. जिंक ऑक्साइड सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया करके सोडियम जिंकेट और जल उत्पन्न करता है।
ZnO + 2NaOH → Na2ZnO2 + H2O
3. धातु ऑक्साइड की जल में विलेयता
अधिकांश धातु ऑक्साइड पानी में अघुलनशील होते हैं लेकिन इनमें से कुछ क्षार बनाने के लिए पानी में घुल जाते हैं। सोडियम ऑक्साइड और पोटेशियम ऑक्साइड को पानी में घोलने से क्रमशः सोडियम हाइड्रॉक्साइड क्षार और पोटेशियम हाइड्रॉक्साइड क्षार मिलते हैं।
Na2O (s) + H2O (l) → 2NaOH (aq)
K2O (s) + H2O (l) → 2KOH (aq)
अधातु
अधातु वे तत्व हैं जो विद्युत का संचालन नहीं करते हैं और न ही लचीले हैं और न ही तन्य हैं।
उदाहरण:- कार्बन (C), सल्फर (S), फॉस्फोरस (P), सिलिकॉन (Si), हाइड्रोजन (H), ऑक्सीजन (O), नाइट्रोजन (N), क्लोरीन (Cl), ब्रोमीन (Br), नियॉन ( Ne) और आर्गन (Ar), आदि।
अधातु वे तत्व हैं जो इलेक्ट्रॉन ग्रहण करके ऋणात्मक आयन बनाते हैं। अत: अधातुओं को विद्युतचुम्बकीय तत्व भी कहा जाता है।
अधातुओं के भौतिक गुण
1. अधातु कठोर और चमकदार नहीं होती हैं
अधातुएँ कठोर नहीं होतीं बल्कि सामान्यत: नरम होती हैं। लेकिन हीरा अपवाद है। यह प्राकृतिक रूप से पाया जाने वाला सबसे कठोर और चमकदार पदार्थ है। आयोडीन चमकदार सतह वाला चमकदार होता है।
2. अधातुएँ चमकदार नहीं होती हैं
अधातुएँ चमकदार नहीं होती हैं। हीरा और आयोडीन अपवाद हैं।
3. अधातु ठोस, द्रव या गैस हो सकती है।
4. अधातुएँ ध्वनिक नहीं होती हैं।
अधातुएँ ध्वनिक नहीं होती हैं, अर्थात् टकराने पर वे विशिष्ट ध्वनि उत्पन्न नहीं करती हैं।
5.अधातु ऊष्मा और विद्युत की कुचालक होती है
अधातुएँ ऊष्मा और विद्युत की कुचालक होती हैं। ग्रेफाइट, जो कार्बन का अपरूप है, विद्युत का सुचालक है और एक अपवाद है।
6. अधातुएँ लचीली नहीं होती हैं।
7. अधातुएँ तन्य नहीं होती हैं।
8. अधातुओं का गलनांक और क्वथनांक कम होता है
हीरे को छोड़कर, गैर-धातुओं में आमतौर पर कम गलनांक और क्वथनांक होता है
9. अधिकांश अधातुओं का घनत्व कम होता है।
10. अधातु कई रंगों में होती है।
अधातुओं के रासायनिक गुण
1. अधातुओं की ऑक्सीजन के साथ अभिक्रिया
अधातुएँ ऑक्सीजन से अभिक्रिया करके संगत ऑक्साइड बनाती हैं।
अधातु + ऑक्सीजन → अधात्विक ऑक्साइड
उदाहरण:-
1. जब कार्बन ऑक्सीजन के साथ अभिक्रिया करता है, तो ऊष्मा के उत्पादन के साथ कार्बन डाइऑक्साइड बनता है।
C + O2 → CO2 + ऊष्मा
2. जब कार्बन को हवा की अपर्याप्त आपूर्ति में जलाया जाता है, तो यह कार्बन मोनोऑक्साइड बनाता है। कार्बन मोनोऑक्साइड एक जहरीला पदार्थ है। कार्बन मोनोऑक्साइड का साँस लेना घातक साबित हो सकता है।
2C + O2 → 2CO + ऊष्मा
3. सल्फर ऑक्सीजन से अभिक्रिया करने पर सल्फर डाइऑक्साइड देता है। हवा के संपर्क में आने पर सल्फर में आग लग जाती है।
S + O2 → SO2
4. जब हाइड्रोजन ऑक्सीजन से अभिक्रिया करता है तो पानी देता है।
2H2 + O2 → 2H2O
अधात्विक ऑक्साइड
अधात्विक ऑक्साइड अम्लीय प्रकृति के होते हैं। अधातु ऑक्साइड का विलयन नीले लिटमस को लाल कर देता है।
उदाहरण:-
1. कार्बन मोनोऑक्साइड पानी में घुलने पर कार्बोनिक एसिड देता है।
CO2 + H2O → H2CO3
2. सल्फर डाइऑक्साइड जल में घुलने पर सल्फ्यूरस अम्ल देती है।
SO2 + H2O → H2SO3
3. सल्फर डाइऑक्साइड ऑक्सीजन के साथ अभिक्रिया करने पर सल्फ्यूरिक अम्ल देती है।
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
2. अधातु की क्लोरीन के साथ अभिक्रिया
अधातु क्लोरीन गैस के साथ अभिक्रिया करने पर संबंधित क्लोराइड देता है।
अधातु + क्लोरीन → अधातु क्लोराइड
उदाहरण:- हाइड्रोजन हाइड्रोजन क्लोराइड देता है और फॉस्फोरस क्लोरीन के साथ क्रिया करने पर फॉस्फोरस ट्राइक्लोराइड देता है।
H2 + Cl2 → 2HCl
P4 + 2Cl2 → 4PCl3
3. अधातुओं की हाइड्रोजन के साथ अभिक्रिया
अधातुएँ हाइड्रोजन से अभिक्रिया करके सहसंयोजक हाइड्राइड बनाती हैं।
अधातु + हाइड्रोजन → सहसंयोजक हाइड्राइड
उदाहरण:-
1. सल्फर हाइड्रोजन के साथ मिलकर एक सहसंयोजक हाइड्राइड बनाता है जिसे हाइड्रोजन सल्फाइड कहा जाता है।
H2 + S → H2S
2. नाइट्रोजन एक लौह उत्प्रेरक की उपस्थिति में हाइड्रोजन के साथ संयोग करके सहसंयोजी हाइड्राइड अमोनिया बनाती है।
N2 + 3H2 → 2NH3
**नोट:- 1. अधातुएँ जल या भाप से अभिक्रिया नहीं करके हाइड्रोजन गैस बनाती हैं।
2. अधातुएँ तनु अम्लों से अभिक्रिया नहीं करती हैं।
4. धातु और अधातु की अभिक्रिया
कई धातुएँ अधातुओं के साथ अभिक्रिया करके आयनिक बंध बनाती हैं। इस प्रकार बनने वाले यौगिकों को आयनिक यौगिक कहते हैं।
आयन:- धनात्मक तथा ऋणात्मक आवेशित अणु या परमाणु आयन कहलाते हैं। आयनों का निर्माण इलेक्ट्रॉनों के हानि या लाभ के कारण होता है। परमाणु आयन बनाते हैं जो निकटतम उत्कृष्ट गैस के इलेक्ट्रॉनिक विन्यास द्वारा प्राप्त होते हैं।
धनात्मक आयन (Cation):- एक परमाणु द्वारा इलेक्ट्रॉनों की हानि के कारण धनात्मक आयन बनता है।
उदाहरण:- 1. सोडियम एक इलेक्ट्रॉन की हानि के कारण सोडियम आयन बनाता है।
2. मैग्नीशियम दो इलेक्ट्रॉनों की हानि के कारण धनात्मक आयन बनाता है।

ऋणात्मक आयन (आयन):- एक ऋणात्मक आयन एक इलेक्ट्रॉन के लाभ के कारण बनता है।
उदाहरण:- 1. स्थिर विन्यास प्राप्त करने के लिए क्लोरीन एक इलेक्ट्रॉन ग्रहण करता है। एक इलेक्ट्रॉन की लाभ के बाद, क्लोरीन उस पर एक ऋणात्मक आवेश प्राप्त करता है जिससे क्लोरीन आयन बनता है।
धनायन या ऋणायन क्यों बनते हैं:-
अक्रिय गैसें स्थिर तत्व हैं। नोबल गैसों के अलावा हर तत्व खुद को स्थिर बनाने के लिए इलेक्ट्रॉनों को देता है, हासिल करता है या साझा करता है। इलेक्ट्रॉनों के नुकसान या लाभ के कारण तत्व आवेशित हो जाते हैं (धनायन या आयन)।
धनायन और ऋणायन को समझने के लिए हमें तत्वों के इलेक्ट्रॉनिक विन्यास और उनकी संयोजकता को समझना होगा।
संयोजकता :-
किसी परमाणु के सबसे बाहरी कोश में उपस्थित संयोजी इलेक्ट्रॉनों की संख्या संयोजकता कहलाती है।
उदाहरण:- सोडियम (Na) का इलेक्ट्रॉनिक विन्यास = 2 8 1
सोडियम परमाणु में उनके तीन कोश होते हैं और सबसे बाहरी कोश में 1 इलेक्ट्रॉन होता है, इसलिए सोडियम का संयोजी इलेक्ट्रॉन 1 होता है।
- यदि सबसे बाहरी कोश में 1, 2, 3 या 4 इलेक्ट्रॉन हैं, तो ये इलेक्ट्रॉनों के बंटवारे में दिए जा सकते हैं। तो 1, 2, 3, या 4 संयोजी इलेक्ट्रॉन होंगे।
- यदि सबसे बाहरी कोश में 5, 6 या 7 इलेक्ट्रान हों तो इलेक्ट्रानों के बंटवारे में नहीं दिया जा सकता क्योंकि इन्हें अपना अष्टक पूरा करने के लिए इलेक्ट्रानों की आवश्यकता होती है।
5 इलेक्ट्रॉनों वाले सबसे बाहरी कोश के लिए आवश्यक संयोजी इलेक्ट्रॉन = 8 - 5 = 3
6 इलेक्ट्रॉनों वाले सबसे बाहरी कोश के लिए आवश्यक संयोजी इलेक्ट्रॉन = 8 - 6 = 2
7 इलेक्ट्रॉनों वाले सबसे बाहरी कोश के लिए आवश्यक संयोजी इलेक्ट्रॉन = 8 - 7 = 1

धनायन और ऋणायन कैसे बनते हैं
एक परमाणु के नाभिक में प्रोटॉन की संख्या और इलेक्ट्रॉनों की संख्या के बीच अंतर परमाणु पर धनात्मक या ऋणात्मक आवेश उत्पन्न करता है और आयन बनाता है।
उदाहरण:- 1. सोडियम परमाणु के सबसे बाहरी कोश में एक इलेक्ट्रॉन होता है। यदि यह अपने M-शेल से इलेक्ट्रॉन को खो देता है तो इसका L-शेल अब सबसे बाहरी कोश बन जाता है और इसमें एक स्थिर अष्टक होता है। इस परमाणु के नाभिक में अभी भी 11 प्रोटॉन हैं लेकिन इलेक्ट्रॉनों की संख्या 10 हो गई है। इसलिए एक शुद्ध धनात्मक आवेश है जो हमें सोडियम धनायन Na+ देता है।
2. एक क्लोरीन परमाणु के सबसे बाहरी कोश में 7 इलेक्ट्रॉन होते हैं। इसे अपना अष्टक पूरा करने के लिए 1 इलेक्ट्रॉन की आवश्यकता होती है। यदि यह 1 इलेक्ट्रॉन प्राप्त करता है तो इसका M-शेल सबसे बाहरी कोश बन जाता है जिसमें एक स्थिर अष्टक होता है।
इस परमाणु के नाभिक में अभी भी 17 प्रोटॉन हैं लेकिन इलेक्ट्रॉन की संख्या 18 हो गई है। इसलिए एक शुद्ध ऋणात्मक आवेश है जो हमें क्लोरीन आयन Cl- देता है।
आयनिक बन्ध:-
धातु से अधातु में इलेक्ट्रॉनों के स्थानांतरण के कारण आयनिक बंध बनते हैं। इस क्रम में धातुओं को इलेक्ट्रॉनों के स्थानान्तरण के कारण धनात्मक आवेश प्राप्त होता है और अधातु को इलेक्ट्रॉनों की स्वीकृति के कारण ऋणात्मक आवेश प्राप्त होता है। दूसरे शब्दों में, धनात्मक और ऋणात्मक आयन के बीच बनने वाले बंध को आयनिक बंध या विद्युत संयोजी बंध कहते हैं।
आयनिक यौगिक
एक धातु से अधातु में इलेक्ट्रॉनों के स्थानांतरण द्वारा बनने वाले यौगिकों को आयनिक यौगिक या इलेक्ट्रोवैलेंट यौगिक के रूप में जाना जाता है।
उदाहरण:- सोडियम क्लोराइड में सोडियम एक धातु है और क्लोरीन एक अधातु है। एक इलेक्ट्रॉन की हानि के बाद, सोडियम को एक धनात्मक आवेश (+) प्राप्त होता है और क्लोरीन को एक इलेक्ट्रॉन के लाभ के बाद एक ऋणात्मक आवेश प्राप्त होता है। सोडियम क्लोराइड इलेक्ट्रॉनों के स्थानांतरण के कारण बनता है।

आयनिक यौगिकों के गुण
- आयनिक यौगिक ठोस होते हैं। आयनिक बंध में आकर्षण बल अधिक होता है जिसके कारण आयन एक दूसरे को दृढ़ता से आकर्षित करते हैं। यह आयनिक यौगिकों को ठोस बनाता है।
- आयनिक यौगिक भंगुर होते हैं।
- आयनिक यौगिकों में उच्च गलनांक और क्वथनांक होते हैं क्योंकि आयनिक यौगिकों के आयनों के बीच आकर्षण बल बहुत मजबूत होता है।
- आयनिक यौगिक आमतौर पर पानी में घुल जाते हैं।
- आयनिक यौगिक आमतौर पर कार्बनिक सॉल्वैंट्स जैसे मिट्टी के तेल, पेट्रोल आदि में अघुलनशील होते हैं।
- आयनिक यौगिक ठोस अवस्था में विद्युत का चालन नहीं करते हैं।
- पानी में आयनिक यौगिकों का विलयन विद्युत का चालन करता है। ऐसा इसलिए होता है क्योंकि आयनिक यौगिकों के विलयन में मौजूद आयन विपरीत इलेक्ट्रोड की ओर बढ़ कर विद्युत के मार्ग को सुगम बनाते हैं।
- आयनिक यौगिक गलित अवस्था में विद्युत का चालन करते हैं।
धातुओं की उपस्थिति और निष्कर्षण
धातुओं के स्रोत :- धातुएँ पृथ्वी की भू - पर्पटी में तथा समुद्री जल में अयस्कों के रूप में पाई जाती हैं। पृथ्वी की पर्पटी धातु का प्रमुख स्रोत है। समुद्री जल में कई लवण होते हैं जैसे सोडियम क्लोराइड, मैग्नीशियम क्लोराइड आदि।
खनिज:- खनिज प्राकृतिक रूप से पाए जाने वाले पदार्थ हैं जिनका संघटन एक समान होता है।
अयस्क:- जिस खनिज से धातु को लाभकारी रूप से निकाला जा सकता है उसे अयस्क कहते हैं।
गैंग (Gangue) :- पृथ्वी से निकाले गए अयस्कों में आमतौर पर बड़ी मात्रा में अशुद्धियाँ जैसे मिट्टी, बालू आदि दूषित हो जाते हैं, गैंग कहलाते हैं।
- अभिक्रियाशीलता श्रृंखला के निचले भाग में पाई जाने वाली धातुएं कम से कम अभिक्रियाशील होती हैं और वे अक्सर प्रकृति में मुक्त अवस्था में पाई जाती हैं, जैसे सोना, चांदी, तांबा, आदि। तांबा और चांदी भी सल्फाइड और ऑक्साइड अयस्कों के रूप में पाए जाते हैं।
- प्रतिक्रियाशील श्रृंखला के मध्य में पाए जाने वाले धातु, जैसे Zn, Fe, Pb, आदि आमतौर पर ऑक्साइड, सल्फाइड या कार्बोनेट के रूप में पाए जाते हैं।
- अभिक्रियाशीलता श्रृंखला के शीर्ष पर पाए जाने वाले धातु कभी भी मुक्त अवस्था में नहीं पाए जाते हैं क्योंकि वे बहुत अभिक्रियाशील होते हैं। उदाहरण- K, Na, Ca, Mg, Al आदि।
- कई धातुएं ऑक्साइड के रूप में पाई जाती हैं क्योंकि ऑक्सीजन प्रकृति में प्रचुर मात्रा में होती है और बहुत अभिक्रियाशील होती है।
धातुओं का निष्कर्षण
धातुओं को उनकी क्रियाशीलता के आधार पर तीन भागों में वर्गीकृत किया जा सकता है। सबसे अधिक क्रियाशील, मध्यम क्रियाशील और सबसे कम क्रियाशील। किसी धातु के अयस्क से उसके निष्कर्षण में शामिल तीन प्रमुख चरण हैं-
- अयस्कों का सांद्रण या संवर्धन।
- सांद्रित अयस्क का कच्चे धातु में परिवर्तन।
- अशुद्ध या कच्चे धातु का शोधन।
खदानों के अयस्क से मिट्टी, रेत, पत्थर, सिलिकेट आदि अशुद्धियों को दूर करना अयस्कों का सांद्रण कहलाता है।
जिन अयस्कों का खनन किया जाता है उनमें अक्सर कई अशुद्धियाँ होती हैं। सबसे पहले अयस्कों से अशुद्धियों को दूर करने के लिए सांद्रण किया जाता है। अयस्कों की सघनता को अयस्कों का संवर्धन भी कहा जाता है। गुरुत्वाकर्षण पृथक्करण, विद्युत चुम्बकीय पृथक्करण, झाग प्लवन विधि आदि प्रक्रियाओं के कुछ उदाहरण हैं जो अयस्कों की सांद्रता के लिए लागू होते हैं।
2. सांद्रित अयस्क का कच्चे धातु में परिवर्तन
धातुओं के अयस्कों का ऑक्साइड में परिवर्तन: धातुओं को उनके ऑक्साइड से प्राप्त करना आसान होता है। अतः सल्फाइड और कार्बोनेट के रूप में पाए जाने वाले अयस्कों को भर्जन और निस्तापन की प्रक्रिया द्वारा सबसे पहले उनके ऑक्साइड में परिवर्तित किया जाता है। इस प्रकार प्राप्त धातुओं के ऑक्साइड अपचयन की प्रक्रिया द्वारा धातुओं में परिवर्तित हो जाते हैं।
भर्जन:- सल्फाइड अयस्कों को आक्साइड में बदलने के लिए आधिक्य वायु की उपस्थिति में गर्म करना भर्जन के रूप में जाना जाता है।
निस्तापन:- कार्बोनेट अयस्कों को आक्साइड में परिवर्तित करने के लिए हवा की सीमित आपूर्ति में गर्म करना निस्तापन के रूप में जाना जाता है।
भर्जन तथा निस्तापन में अंतर:-
3. अपचयन
धातुओं के ऑक्साइडों को धातु में बदलने के लिए गर्म करना अपचयन कहलाता है।
(i) कम क्रियाशीलता वाली धातुओं का निष्कर्षण
पारा और तांबा, जो सबसे कम क्रियाशीलता श्रृंखला से संबंधित हैं, अक्सर ये सल्फाइड अयस्कों के रूप में पाए जाते हैं।
पारा का निष्कर्षण:
सिनेबार (HgS) को सबसे पहले वायु की उपस्थिति में गर्म किया जाता है। यह सल्फर डाइऑक्साइड मुक्त करके HgS (मर्करी सल्फाइड) को HgO (मर्करी ऑक्साइड) में बदल देता है। इस प्रकार प्राप्त मरकरी ऑक्साइड को पुनः उच्च ताप पर गर्म किया जाता है। यह मरकरी ऑक्साइड को पारा धातु में अपचयित कर देता है।
कॉपर(तांबा) का निष्कर्षण:
कॉपर ग्लांस (Cu2S) का वायु की उपस्थिति में भर्जन किया जाता है। भर्जन से कॉपर ग्लांस, कॉपर (I) ऑक्साइड में बदल जाती है। कॉपर ऑक्साइड को वायु की अनुपस्थिति में गर्म किया जाता है। यह कॉपर (I) ऑक्साइड को कॉपर धातु में अपचयित कर देता है।
(ii) मध्यम क्रियाशीलता की धातुओं का निष्कर्षण
लोहा, जस्ता, सीसा आदि कार्बोनेट या सल्फाइड अयस्कों के रूप में पाए जाते हैं। धातुओं के कार्बोनेट या सल्फाइड अयस्कों को पहले संबंधित ऑक्साइड में परिवर्तित किया जाता है और फिर ऑक्साइड को संबंधित धातुओं में अपचयित किया जाता है।
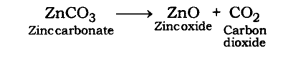
जिंक का निष्कर्षण:
जिंक ब्लेंड (ZnS) और कैलामाइन (ZnCO3) जिंक के अयस्क हैं। जिंक ब्लेंड को जिंक ऑक्साइड में परिवर्तित करने के लिए भर्जन किया जाता है।
कैलामाइन को जिंक ऑक्साइड में परिवर्तित करने के लिए निस्तापन किया जाता है।
इस प्रकार प्राप्त जिंक ऑक्साइड कार्बन (एक अपचायक) के साथ गर्म करने पर जिंक धातु में अपचयित हो जाता है।
लोहे का निष्कर्षण:
हेमेटाइट (Fe2O3) अयस्क को कार्बन के साथ गर्म करके लौह धातु में अपचयित किया जाता है।
लेड(सीसा) का निष्कर्षण:
लेड ऑक्साइड को कार्बन के साथ गर्म करके लेड धातु में अपचयित किया जाता है।
एल्युमिनियम के साथ गर्म करने से धातु ऑक्साइड का अपचयन
धातु ऑक्साइड को धातु में अपचयित करने के लिए एल्यूमीनियम (अपचायक) के साथ गर्म किया जाता है।
उदाहरण:- एल्युमिनियम के साथ गर्म करने पर मैंगनीज डाइऑक्साइड और कॉपर ऑक्साइड संबंधित धातुओं में अपचित हो जाते हैं।
थर्माइट अभिक्रिया
कुछ विस्थापन अभिक्रियाएँ अत्यधिक ऊष्माक्षेपी होती हैं, उत्पन्न ऊष्मा की मात्रा इतनी अधिक होती है कि धातुएँ गलित अवस्था में प्राप्त होती हैं। ऐसी अभिक्रिया को थर्माइट अभिक्रिया के रूप में जाना जाता है।
उदाहरण:- फेरिक ऑक्साइड को एल्युमिनियम के साथ गर्म करने पर लौह धातु में अपचयित हो जाता है। इस अभिक्रिया में अत्यधिक ऊष्मा उत्पन्न होती है।
थर्माइट अभिक्रिया का उपयोग:- थर्माइट अभिक्रिया का उपयोग इलेक्ट्रिक कंडक्टर, लोहे के जोड़ों, मशीन के टूटे हुए पुर्जों आदि जैसे रेलवे ट्रैक में जोड़ों की वेल्डिंग में किया जाता है। इसे थर्माइट वेल्डिंग (TW) के नाम से भी जाना जाता है।
(iii) उच्च क्रियाशीलता वाली धातुओं का निष्कर्षण
उच्च प्रतिक्रियाशीलता वाली धातुएं जैसे सोडियम, कैल्शियम, मैग्नीशियम, एल्युमिनियम आदि को विद्युत अपघटन द्वारा उनके अयस्कों से निकाले जाते हैं। कार्बन का उपयोग करके इन धातुओं को अपचयन नहीं किया जा सकता है क्योंकि कार्बन इनसे कम क्रियाशील है।
विद्युत अपघटन
धातु अयस्कों की पिघली हुई अवस्था में विद्युत धारा प्रवाहित होती है। धनात्मक आवेश वाली धातु कैथोड के ऊपर जमा हो जाती है।
उदाहरण:- जब विद्युत धारा को गलित अवस्था या सोडियम क्लोराइड के विलयन में प्रवाहित किया जाता है तो सोडियम धातु कैथोड के ऊपर जमा हो जाती है।
विद्युत अपघटन की प्रक्रिया से प्राप्त धातुएं शुद्ध होती हैं।
धातुओं का शोधन या शुद्धिकरण
विभिन्न तरीकों से निकाली गई धातुओं में कुछ अशुद्धियाँ होती हैं, इस प्रकार, उन्हें निकालने की आवश्यकता होती है। अधिकांश धातुओं को इलेक्ट्रोलाइटिक शोधन का उपयोग करके परिष्कृत किया जाता है।
इलेक्ट्रोलाइटिक शोधन:- इलेक्ट्रोलाइटिक शोधन की प्रक्रिया में, अशुद्ध धातु की एक छड और शुद्ध धातु की एक पतली पट्टी को धातु के लवण के घोल में डुबोया जाता है। जब विलयन में विद्युत धारा प्रवाहित की जाती है, तो शुद्ध धातु, शुद्ध धातु की एक पतली पट्टी के ऊपर अशुद्ध धातु की एक छड से निकलकर जमा हो जाती है। इसमें अशुद्ध धातु को एनोड के रूप में तथा शुद्ध धातु को कैथोड के रूप में प्रयोग किया जाता है।
कॉपर का इलेक्ट्रोलाइटिक शोधन:- कॉपर सल्फेट के घोल में अशुद्ध तांबे की एक छड और शुद्ध तांबे की एक पतली पट्टी डुबोई जाती है। धातु की अशुद्ध छड धनात्मक ध्रुव से जुड़ी होती है और शुद्ध धातु की पतली पट्टी ऋणात्मक ध्रुव से जुड़ी होती है। जब विलयन में विद्युत धारा प्रवाहित की जाती है, तो शुद्ध धातु का एनोड कैथोड की ओर गति करता है और उसके ऊपर जमा हो जाता है। धातु में मौजूद अशुद्धियाँ घोल में एनोड के तल के पास जमा हो जाती हैं। विलयन में जमी हुई अशुद्धियाँ एनोड मड कहलाती हैं।
संक्षारण
अधिकांश धातुएं वायुमंडलीय वायु के साथ अभिक्रिया करती रहती हैं। इससे धातु के ऊपर एक परत बन जाती है। लंबे समय में, ऑक्साइड या सल्फाइड या कार्बोनेट आदि में रूपांतरण के कारण धातु की अंतर्निहित परत खोती रहती है। परिणामस्वरूप, धातु ख़त्म हो जाती है। इस प्रक्रिया को धातु का संक्षारण कहते हैं।
लोहे में जंग लगना
लोहे में जंग लगना संक्षारण सबसे आम रूप है। जब लोहा हवा में मौजूद नमी के संपर्क में आता है, तो लोहे की ऊपरी परत आयरन ऑक्साइड (Fe2O3.32H2O) में बदल जाती है, जिसका रंग लाल-भूरा होता है और इसे जंग के रूप में जाना जाता है। इस घटना को लोहे में जंग लगना कहते हैं।
जंग से बचाव :- जंग लगने के लिए लोहे को ऑक्सीजन और पानी के संपर्क में आना चाहिए। वायुमंडलीय नमी और लोहे के बीच अभिक्रिया को रोककर जंग को रोका जाता है। यह निम्न द्वारा किया जा सकता है-
1. पेंटिंग
2. ग्रीसिंग या तेल लगाना
3. गैल्वनीकरण
4. इलेक्ट्रोप्लेटिंग
5. मिश्रधातु
गैल्वनीकरण :- यह स्टील और लोहे को जिंक की एक पतली परत से साथ कोटिंग करके जंग से बचाने की एक विधि है। इस प्रक्रिया को गैल्वनीकरण के रूप में जाना जाता है।
इलेक्ट्रोप्लेटिंग:- इलेक्ट्रोप्लेटिंग मूल रूप से धातु के क्षरण को रोकने के लिए या सजावटी उद्देश्यों के लिए हाइड्रोलिसिस(जल अपघटन) द्वारा एक धातु को दूसरे पर चढ़ाने की प्रक्रिया है।
मिश्रधातु:- वस्तुएँ बनाने में शुद्ध धातुओं का प्रयोग नहीं किया जाता है। इसमें कुछ अन्य पदार्थ भी मिलाए जाते हैं जो उन्हें कठोर और मजबूत बनाते हैं और धातु के गुणों में परिवर्तन का कारण बनते हैं। इस प्रक्रिया को मिश्रधातु कहते हैं।
मिश्र धातु
दो या दो से अधिक धातुओं, या एक धातु और एक अधातु के सजातीय मिश्रण को मिश्र धातु कहा जाता है।
मिश्र धातुओं के कुछ उदाहरण हैं-
1. पीतल - 80% Cu + 20% Zn
2. कांस्य(कांसा) - 90% Cu + 10% Sn
3.सोल्डर - 50% पंजाब + 50% एसएन
4. ड्यूरालुमिन - 95% Al + 4% Cu + 0.5% Mg + 0.5% Mn
5. स्टील - 99.95% Fe + 0.05% C
6. स्टेनलेस स्टील -74% Fe + 18% Cr + 8% Ni
7. मैग्नीशियम मिश्र धातु - 95% अल + 5% मिलीग्राम
8.जर्मन सिल्वर - 60% Cu + 20% Zn + 20% Ni
9. सोने की मिश्रधातु - शुद्ध सोना 24 कैरेट का कहा जाता है। सोने को कठोर बनाने के लिए उसमें थोड़ी मात्रा में चांदी या तांबा मिलाया जाता है।
10. अमलगम - एक मिश्रधातु जिसमें पारा (Hg) मौजूद होता है। उदाहरण के लिए सोडियम अमलगम्स [Na(Hg)] और जिंक अमलगम्स [Zn(Hg)]।
मिश्र धातु के गुण
- मिश्र धातुएँ उस धातु से अधिक प्रबल होती हैं जिससे वे प्राप्त की जाती हैं।
- यह संघटक धातुओं की तुलना में कठोर होती है।
- जंग के लिए अधिक प्रतिरोधकता होती है।
- मिश्रधातुओं का गलनांक घटक धातुओं से कम होता है। उदाहरण के लिए सोल्डर [50% Pb +50% Sn] में Pb और Sn की तुलना में कम गलनांक होता है।
- मिश्र धातुओं की विद्युत चालकता घटक धातुओं की तुलना में कम होती है।
इस पाठ को English में पढ़ने के लिए यहां क्लिक करे...PDF डाउनलोड करने के लिए यहां क्लिक करें...

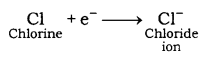

















🙏🙏🙏🙏
ReplyDelete